Pense em crianças brincando de cabo-de-guerra. Supondo que a quantidade de crianças de cada lado seja igual ou de maneira que a força de ambos os lados seja similar, o movimento de um lado para o outro será constante. No entanto, se em um dos lados há alguém muito mais forte, desnivelando as forças da brincadeira, este lado irá ganhar, e o movimento deixará de ocorrer.
O entendimento sobre um dos conceitos mais importantes da química reside nesse movimento da reação, assim como na brincadeira do cabo-de-guerra.
Mas, do que se trata equilíbrio químico? Esse termo refere-se à propriedade de reações que são reversíveis, ou seja, ocorre a partir dos reagentes formando os produtos e vice-versa. Assim que algumas moléculas do produto são formadas, a reação ocorre no sentindo inverso. Dizemos, portanto, que esses tipos de reações são dinâmicos.
O que é equilíbrio químico?
Equilíbrio químico é definido como um processo dinâmico em que as quantidades de reagentes e produtos se mantêm constantes em uma reação dentro de um sistema fechado. Assim, a velocidade da reação direta é igual à velocidade da reação inversa, indefinidamente.
Podemos dizer, então, que a reação de equilíbrio só ocorre se:
- A reação for reversível;
- A velocidade da reação direta for igual à da inversa;
- Ocorrer em ambiente fechado.
É importante lembrar que esse equilíbrio pode ser afetado por temperatura, pressão ou concentração do sistema.
Características
- A velocidade da reação direta é igual à velocidade da reação indireta (independente da concentração dos produtos e reagentes);
- Substâncias em qualquer estado físico podem participar (gases, líquidos, aquosas ou sólidos);
- Os meios nos quais a reação ocorre podem ser ácidos, básicos ou neutros;
- Quando a equação envolve a dissolução de um sal em água, a constante de equilíbrio envolve uma reação de hidrólise salina;
- Forma-se uma solução-tampão, se a solução de reação é composta por um ácido ou uma base fracos + sal;
- A equação pode ser calculada em relação à concentração (mol/L), ao número de íons ou à pressão parcial.
Composição
O equilíbrio é expresso pela fórmula de expressão da constante de equilíbrio (K), ou seja:
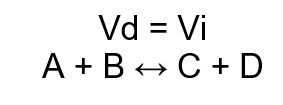
Para calcularmos, segue a fórmula:
K = [produtos]coeficiente / [reagentes]coeficiente
[ ] : concentração molar mol/LK: constante de equilíbrio
Adimensional: não possui unidade de medida
Em gráficos, notamos o equilíbrio químico quando as curvas das concentrações (eixo y) se tornam constantes com o passar do tempo:
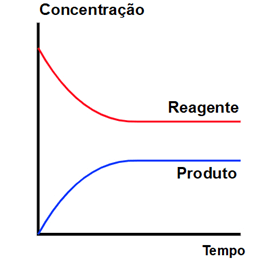
Exemplos
Confira alguns exemplos desse tipo de equilíbrio:
- Equilíbrio gasoso: 2NO2(g) ↔ 2NO(g) + O2(g);
- Equilíbrio com substância sólida: 2 Al2O3 ↔ 4 Al(s) + 3 O2(g).
Exercícios resolvidos
1. UFRGS – Para a reação A ↔ 2B, partindo de “A” puro, o gráfico, a seguir, representa a variação das concentrações de “A” e “B” em função do tempo.
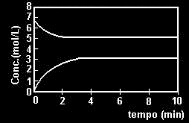
Para essa reação, a constante estequiométrica de equilíbrio, nessas condições, vale:
a) 0,60
b) 0,83
c) 1,20
d) 1,67
e) 1,80
Alternativa “e”. “A” está na curva de cima e “B” está na curva de baixo. Pegamos os valores das concentrações no momento em que as curvas ficam constantes. Aplicando-se a fórmula K = [produtos]coeficiente / [reagentes]coeficiente e temos:
Kc = [3]²/[5]
Kc = 9/5
Kc = 1,8
2. (Fatec) – Nas condições ambientes, é exemplo de sistema em estado de equilíbrio uma:
a) xícara de café bem quente;
b) garrafa de água mineral gasosa fechada;
c) chama uniforme de bico de Bunsen;
d) porção de água fervendo em temperatura constante;
e) tigela contendo feijão cozido.
Alternativa “b”. O equilíbrio químico só acontece quando a velocidade da reação direta é igual ao da reação indireta. O único exemplo no qual o equilíbrio acontece é na garrafa que está fechada.
3. (CEFET–PR) – Com relação ao equilíbrio químico, afirma-se:
I. O equilíbrio químico só pode ser atingido em sistema fechado (onde não há troca de matéria com o meio ambiente);
II. Num equilíbrio químico, as propriedades macroscópicas do sistema (concentração, densidade, massa e cor) permanecem constantes;
III. Num equilíbrio químico, as propriedades microscópicas do sistema (colisões entre as moléculas, formação de complexos ativados e transformações de substâncias em outras) permanecem em evolução, pois o equilíbrio é dinâmico.
É (são) correta(s) a(s) afirmação(ões):
a) Somente I e II.
b) Somente I e III.
c) Somente II e III.
d) Somente I.
e) I, II e III.
Alternativa “e”. Todas estão corretas.