A Lei de Hess foi criada pelo químico suíço Germain Henri Hess, no ano de 1840. Nessa época, o pesquisador descobriu que o calor da neutralização entre um ácido em uma solução aquosa permanecia igual se colocasse o ácido primeiro na água ou vice-versa.
Com base nessa experiência, Hess concluiu que a soma dos calores obtidos em várias concentrações do ácido ou da base aquosa era constante. Por isso, hoje a Lei de Hess estabelece que a variação de uma entalpia em uma reação química depende exclusivamente do estados inicial e final da reação, enquanto que a reação intermediária não altera em nada os resultados:
![]()
Fundamentos da Lei de Hess
A Lei de Hess é uma grande contribuição para a termoquímica, já que por meio desse grande pesquisador e químico foi possível calcular a entalpia de reações químicas para ser utilizada em diversos âmbitos. Um exemplo é a passagem do estado líquido para o gasoso. Veja a equação:
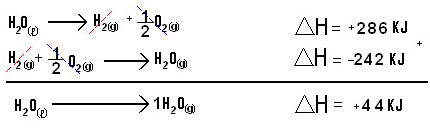
Essa é uma equação global, que permite verificar se o H final pode ser obtido pela soma do H intermediário. O resultado final é que a variação da entalpia é a mesma.
Confira um exemplo prático e de fácil compreensão
Você precisa ir ao shopping fazer compras, mas, para chegar lá, tem 3 caminhos: um mais curto, um intermediário e o terceiro mais longo. Não importa qual você escolherá, afinal tem suas razões, mas, de qualquer forma, o destino final será o mesmo.
Ou seja, o local de partida e chegada serão os mesmos, independente do caminho escolhido. É justamente dessa forma que funciona o valor da entalpia, pois ela depende exclusivamente do estado inicial e final, não importando qual é o estado intermediário.
A Lei de Hess foi uma das grandes novidades da termoquímica, tendo como seu principal fundamento a Conservação da Energia. É por isso que hoje as equações químicas podem ser somadas como contas matemáticas.
Foi Henri Hess que afirmou que a energia não pode ser criada e nem destruída, apenas trocada de uma forma ou de outra, por isso, a soma das equações químicas podem levar à mesma equação resultante.
Como a Lei de Hess pode ser aplicada na prática?
O objetivo da Lei de Hess é calcular a variação da entalpia envolvida nas reações, isso é feito por meio de diversas combinações de equações químicas, desde que os valores da entalpia sejam completamente conhecidos.
Pode-se comparar as equações termoquímicas a cálculos matemáticos, pois nelas são adotados soma, multiplicação, divisão e inversão de equações para igualar coeficientes, com o intuito de chegar na equação desejada.
Resumindo, a Lei de Hess soma os calores de reação, ou seja, e equação calcula a variação da entalpia pelos calores das reações intermediárias:
![]()
No exemplo a seguir, serão calculados o valor da variação da entalpia dessa reação:
![]()
Confira as equações intermediárias:
![]()
![]()
Resolução:
![]()
![]() ______________________________________
______________________________________
![]()
O primeiro passo foi a soma do valor da entalpia (AH1 + AH2), depois as somas das reações químicas para a obtenção da reação global.
Para conseguir montar as equações e, de fato, aplicar a Lei de Hess, é preciso alterar algumas questões matemáticas, como:
- Todas as equações intermediárias devem estar de acordo com a reação global;
- Arrumar os coeficientes de acordo com a reação global;
- Somar para montagem da reação global;
- Efetuar a soma dos valores AH das equações intermediárias para então, encontrar AH da reação global;
Veja como fica o exemplo de um cálculo de entalpia da seguinte reação:
![]() Dados:
Dados:
![]()
![]()
![]()
Veja como deve ser feito:

É muito comum que esses cálculos utilizando a Lei de Hess sejam solicitados em provas de vestibular. Portanto, faz-se necessário entender os fundamentos dessa equação.
Em suma, a Lei de Hess é muito importante para a termoquímica, pois com ela é possível estabelecer que o valor da entalpia só depende dos estados iniciais e finais de uma reação, não importando qual é o estado intermediário.
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
👉 Continue Lendo.. Clique aqui