Elementos químicos constituem toda a matéria que nos forma, que compõem os seres vivos e inanimados ao nosso redor. Estes elementos podem ser comparados entre si quanto às suas propriedades: número atômico, número de massa e número de nêutrons. Estas comparações classificam-os como isótopos, isóbaros e isótonos.
Dentre eles, os mais famosos são os isótopos, pois são muito usados na medicina, na agricultura e, até mesmo, na ecologia, como você verá mais, abaixo. Um tipo muito interessante de isótopos é o radioativo, ou radioisótopos, pois são capazes de emitir radiações, sendo empregados para o tratamento de doenças como o câncer.

O que são isótopos?
Um determinado elemento químico é definido como um grupo de átomos que apresentam o mesmo número atômico (Z). No entanto, na natureza, os elementos químicos podem possuir propriedades semelhantes, ao mesmo tempo que outra os diferencia. Esses elementos são então chamados de isótopos, isóbaros e isótonos.
Os isótopos são aqueles que, apesar de possuírem o mesmo número atômico, diferem quanto ao número de massa (A). Ou seja, contêm o mesmo número de prótons (Z), mas diferente número de nêutrons (n). Eles são, portanto, átomos pertencentes ao mesmo elemento químico. Assim, em geral, possuem as mesmas propriedades químicas (que dependem do número atômico), como a solubilidade. Mas, podem ter diferentes propriedades físicas, como a densidade.
Já os isóbaros possuem o mesmo valor de massa (A) e valores atômicos diferentes (Z), portanto são elementos químicos diferentes. Isótonos, por outro lado, possuem o mesmo número de nêutrons (n) e diferentes números atômicos (Z) e massa (A). Ainda assim, também são elementos químicos diferentes.
Função
Os isótopos são os átomos que possuem diversas aplicações. Estudos na área de ecologia, por exemplo, têm empregado isótopos estáveis de carbono e nitrogênio para avaliar a estrutura trófica de certos animais em paisagens alteradas, sendo assim, possível entender onde estão se alimentando.
A diferença nas proporções desses isótopos encontrados em partes do corpo dos animais pode determinar se os recursos alimentares vieram da floresta ou de canaviais, por exemplo.
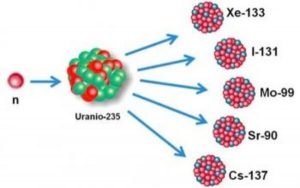
Na medicina, os radioisótopos (aqueles que possuem núcleo radioativo, que permite se transformarem em outro isótopo, chamado de decaimento radioativo) são usados em tratamentos radioterápicos, como no combate ao câncer. Nesse caso, um radioisótopo se liga a uma molécula que indica onde está a célula cancerosa. Durante seu recaimento, ele libera radiações que inibem a multiplicação do DNA da célula e, consequentemente, o crescimento.
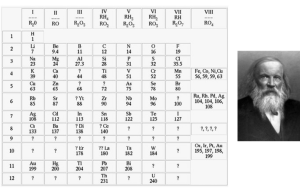
Composição
A tabela, abaixo, demonstra como são compostos estes elementos: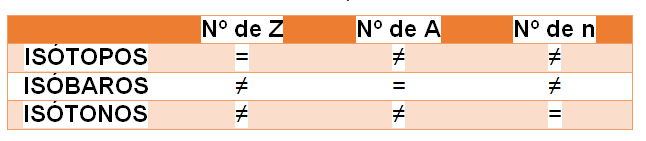
Exemplos
- Isótopos do elemento oxigênio: 8O168O178O18
- Isótopos do elemento hidrogênio: 1H11H21H3
- Isóbaros do hidrogênio e do hélio, ambos com massa A=3: 1H32He3
No entanto, quando hidrogênio e hélio possuem diferentes números de massa, são então isótonos: 1H3, n=2e 2He4, n=2.
Agora que você já sabe um pouco mais a respeito de Isótopos, Isóbaros e Isótonos, que tal testar os seus conhecimentos com os exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também!
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
👉 Continue Lendo.. Clique aqui