Lembra do nosso café com leite, clássico dos exemplos de química? Ele está presente novamente neste artigo, mas, desta vez, para nos ajudar a entender um conceito físico.
Ao misturarmos o café quentinho com o leite frio, podemos notar que, aos poucos, o leite esfria o café à medida que este esquenta o leite – assim obtemos uma mistura morna e agradável de ser consumida.
Dizemos, então, que houve transferência de calor de um corpo com maior temperatura para o de menor temperatura. Este fenômeno é chamado de equilíbrio térmico.

O que é equilíbrio térmico?
Equilíbrio térmico, ou equilíbrio termodinâmico, é definido como o momento no qual dois corpos atingem a mesma temperatura quando em contato com um outro.
Esse conceito é estudado dentro da termodinâmica, e está relacionado à transferência de calor, de forma espontânea, entre dois corpos. Ou seja, o corpo de maior temperatura transfere calor para o corpo de menor temperatura até que ambos atinjam a mesma temperatura.
Esse fenômeno também ocorre quando há adição de um ou mais corpos no mesmo sistema.
Composição
A fórmula que utilizamos para calcular a reação de equilíbrio é:
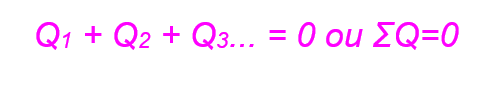
Em que Q representa a quantidade de calor (temperatura dos corpos).
Essa formula demonstra que a soma de todas as energias térmicas do sistema é nula.
Exemplos
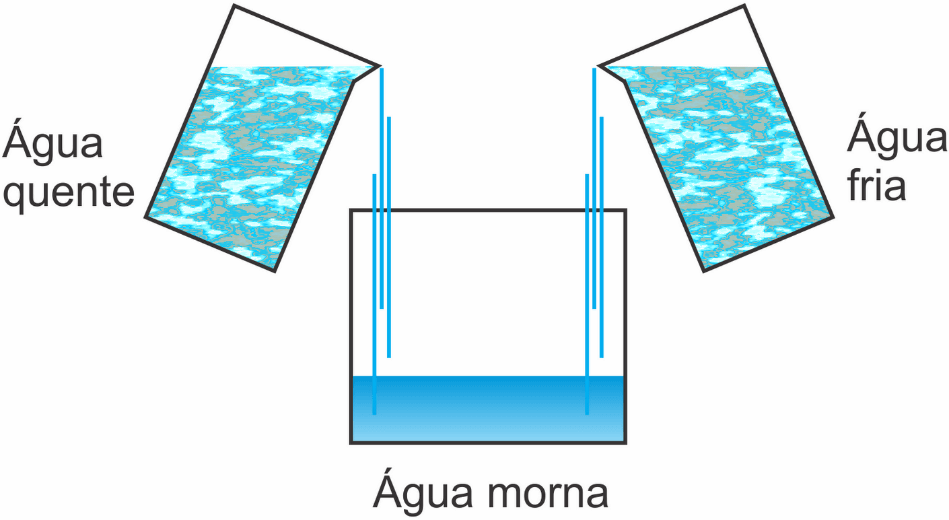
Além do café com leite, podemos pensar na adição de gelo a um copo de suco. Apesar de pensarmos que o gelo transfere frio para o suco, ocorre o oposto, o suco transfere calor ao gelo, que derrete e se mistura com a água.
Mais informações
Calor sensível (ou calor específico)
É a medida de calor necessária para variar a temperatura de um elemento. Segue a seguinte fórmula:
 Em que:
Em que:
Q: quantidade de calor sensível (cal ou J);
m: massa do corpo (g ou Kg);
c: calor específico da substância (cal/g°C ou J/Kg.°C);
Δθ: variação de temperatura (°C ou K).
Exercícios resolvidos
1. (UFMS-MS) No interior de um forno de micro-ondas se encontra um prato que contém 1kg de purê de batatas para ser aquecido.
Considere que o purê de batatas possui calor específico c = 1,8 cal/g° C, e que a capacidade térmica C do prato é de 20 cal/° C. A potência elétrica de consumo do forno é igual a 1.200W, dos quais 80% dessa potência são transferidos como energia térmica para o purê de batatas, o qual, por condução, aquece o prato, considere que somente essa energia é transferida para o prato.
Antes de ligar o forno de micro-ondas, todo esse sistema está em equilíbrio térmico na temperatura de 20° C. Assinale a alternativa que corresponde ao tempo em que o forno de micro-ondas deve ficar ligado para que o prato e o purê de batatas atinjam a temperatura de 50° C. Use a relação que 1 cal = 4,18 J.
a) Igual a 3,6 minutos.
b) Igual a 3,2 minutos.
c) Mais que 3,7 minutos.
d) Igual a 3,0 minutos.
e) Menos que 2,0 minutos.
Alternativa “c”. Aplicando-se a fórmula:
Q=m.c.Δθ=1.000×1,8x(50 20)
Q=54.000calx4,18
Q=225.720J
Assim, 80% da potência de 1.200W é transferida para prato — P=Q/Δt
0,8×1.200=225.720/Δt
Δt=235,125s/60=3,918 minutos
2. (MACKENZIE-SP) Um calorímetro de capacidade térmica 6 cal/°C contém 80g de água (calor específico = 1 cal/g°C) a 20°C. Ao se colocar um bloco metálico de capacidade térmica 60 cal/°C, a 100°C, no interior desse calorímetro, verificou-se que a temperatura final de equilíbrio térmico é 50°C. A quantidade de calor perdida para o ambiente, nesse processo, foi de:
a) 420 cal
b) 370 cal
c) 320 cal
d) 270 cal
e) 220 cal
Alternativa “a”. Aplicando-se a fórmula Q = m . c . Δθ, temos 420 cal.
3. (MACKENZIE) Quando misturamos 1,0 kg de água (calor específico sensível = 1,0 cal/g°C) a 70°C com 2,0 kg de água a 10°C, obtemos 3,0kg de água a:
a) 10°C
b) 20°C
c) 30°C
d) 40°C
e) 50°C
Alternativa “c”. A soma das quantidades de calor trocadas entre duas substâncias misturadas deve ser igual a zero, logo:
Q1 + Q2 = 0
m1. c. ΔT + m2. c. ΔT = 0
Sabendo que 1 kg = 1000 g, temos:
1000 . 1 . (TF – 70) + 2000 . 1 . (TF – 10) = 0
1000 TF – 70.000 + 2000 TF – 20.000 = 0
3000 TF – 90.000 = 0
3000 TF = 90.000
TF = 90.000 ÷ 3000
TF = 30°C
A temperatura final (TF) da mistura é 30°C.
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
👉 Continue Lendo.. Clique aqui