Como é de se esperar, as ligações metálicas consistem em junções de metais, compostos com várias particularidades, muito utilizados em materiais do dia a dia.
Embora os metais sejam extraídos da natureza, muitos passam por processos industriais para sua adaptação e a produção de bens utilizáveis.
A seguir, saiba todas as informações a respeito do assunto, só aqui no Gestão Educacional!

O que é são ligações metálicas?
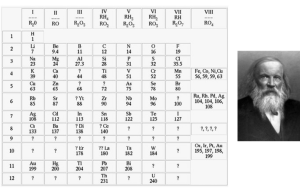
As ligações metálicas, conforme explicado anteriormente, consistem na união de metais. Para isso, vale retomar quais os metais existentes na tabela periódica:
- Metais alcalinos: são todos aqueles presentes na família 1A (ex: lítio e césio);
- Metais alcalinos-terrosos: são aqueles presentes à família 2A, como exemplo o cálcio e o rádio;
- Metais de transição: são todos aqueles localizados na família B da tabela periódica.
Para que a união desses elementos ocorra, é preciso que percam elétrons – isso porque são eletropositivos. Como todos tâm a mesma tendência, a ligação metálica é chamada de “nuvem de elétrons”.
Características das ligações metálicas
É muito simples caracterizar os metais, vistos que se diferenciam das demais ligações e substâncias por suas inúmeras particularidades:
- Possuem brilho próprio;
- São bons condutores de calor e de eletricidade;
- Possuem maleabilidade e são dúcteis;
- Possuem a tendência a formar ligas;
- Têm dureza variável;
- Tendem a ser sólidos em temperatura ambiente.
A ligação dentre metais tem como principal característica a formação de um mar ou nuvem de elétrons, visto que todos os elementos compartilham da mesma propriedade (eletropositividade).
Todos estes elétrons que estão situados ao entorno dos átomos centrais possuem movimentos aleatórios, e, quando aplicada uma corrente elétrica, o movimento torna-se unidirecional.

Composição
Como você já sabe, as ligações metálicas são formadas pela junção entre metais. Mas, para entender como esse mar de elétrons funciona, é importante ressaltar algumas características da ligação:
- Os metais possuem baixa energia de ionização, portanto, tornam-se cátions muito facilmente (isto é, perdem elétrons e adquirem carga positiva);
- A ligação resulta de uma atração eletrostática dentre as cargas;
- A força da ligação metálica é variável, pois depende da carga de cada um dos cátions;
- Os metais se arranjam em retículos metálicos, quando no estado sólido, que são formas geométricas muito bem definidas.
Apesar de as ligações metálicas serem formadas essencialmente por metais, existe, também, a possibilidade de ocorrência de ligas metálicas – assunto para o próximo tópico!
Qual a diferença entre ligação metálica e liga metálica?
As ligas metálicas consistem na união de elementos, sendo que ao menos um destes, obrigatoriamente, deve ser um metal. Mas, diferem-se das ligações metálicas, pois estas contêm exclusivamente metais.
Sendo assim, suas características também diferem-se das ligações metálicas. Pode-se ter como características:
- O ponto de fusão é diferente;
- Tendem a ser mais duros;
- Há aumento da resistência mecânica.
As ligas são utilizadas, por exemplo, para as obturações dentárias a partir da amálgama (que é formada por prata, estanho e mercúrio).
Exemplos
Agora que você já sabe o que são as ligações metálicas e suas propriedades, é interessante conhecer exemplos de sua aplicabilidade no dia a dia.
Um bom exemplos é o alumínio, um metal leve e extremamente resistente, utilizado para a fabricação de embalagens (como latinhas de refrigerante) e para utensílios de cozinha.
Outro exemplo é o cobre, que pode ser transformado em fios de eletricidade. Lembra-se da capacidade existente nas ligações de passagem de corrente elétrica?!
Agora que você já sabe um pouco mais a respeito da ligações metálicas, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
👉 Continue Lendo.. Clique aqui