O átomo é a estrutura que forma a matéria, sendo composto de prótons, nêutrons e elétrons, que ficam ao redor do núcleo, além de outros compostos menores. Foi batizado com esse nome pelos filósofos gregos Demócrito e Leucipo, com o significado de “indivisível”.
Com o passar do tempo, várias teorias surgiram sobre os átomos, então, os modelos atômicos também surgiram. Quer saber mais? Leia, aqui no Gestão Educacional, informações completas a respeito.
História dos átomos

Aristóteles, conhecido filósofo grego, já havia tentado explicar que todas as substâncias existiam a partir dos quatro elementos naturais: terra, fogo, ar e água. Já Demócrito, que era cientista e matemático, disseminou a ideia de que havia um limite para o tamanho das partículas, de que tão pequenas não poderiam mais ser divididas, chamando, então, de átomos. Porém, no século XIX, o modelo mais aceito foi o de Dalton.
Modelos Atômicos: Quais São?
Modelo de Dalton
Chamado também de bola de bilhar, foi criado em 1803, por John Dalton. Segundo o cientista, os átomos são as menores partículas existentes, com formas esféricas e massas parecidas, caso sejam do mesmo elemento químico.
Modelo de Thomson
Conhecido também por pudim de passas, ele foi desenvolvido por Thomson, em 1897, deixando o modelo de Dalton ultrapassado. Isso ocorreu pela descoberta do elétron, partícula interna do átomo, que possui carga elétrica negativa.
Modelo de Rutherford-Bohr
Também chamado de sistema planetário, Rutherford bombardeou algumas partículas alfa, em uma lâmina de ouro, descobrindo que a maioria conseguia atravessar a barreira. Enquanto isso, uma parte menor desviava outra ainda menor, com desvio no sentido contrário da trajetória.
Depois disso, descobriu-se que os átomos não são maciços, mas sim com um grande espaço interno. Além de que são formados por um núcleo positivo e uma nuvem eletrônica negativa. Essas nuvens chamadas de eletrônicas são compostas de elétrons, que giram em órbitas elípticas, em torno do núcleo – da mesma forma que ao redor do Sol, por isso o nome.
Porém, mesmo com essas descobertas, uma questão ainda ficava no ar: diante da teoria das ondas eletromagnéticas, os elétricos que giravam ao redor do núcleo, perderiam a energia, com o passar do tempo, aderindo a um movimento helicoidal, caindo no núcleo. Porém, como isso poderia acontecer se os átomos são classificados como estruturas estáveis?
Depois de dois anos da descoberta de Rutherford, Niel Bohr finalizou-a com três pontos:
- Os elétrons que circulam ao redor do núcleo, possuem órbitas circulares e com uma energia única, chamados assim de órbitas estacionárias;
- Diante do movimento das órbitas estacionárias, os elétrons não liberam nenhum tipo de energia espontânea;
- Quando o elétron recebe energia em seu meio extremo, acontece um salto quântico, migrando por entre dois orbitais. Ele tende a voltar à órbita inicial, onde a energia será recebida na mesma quantidade para o meio dele. Essa energia – enviada e recebida – é conhecida como a diferença energética por entre as duas órbitas.
Mesmo que essa teoria de Rutherford-Bohr seja muito difundida nas escolas, possui algumas falhas, porque:
- Os elétrons, na teoria, não fazem nenhum tipo de trajetória circular ou elíptica em torno do núcleo;
- Não há explicação do porquê os elétrons perdem energia quando estão em movimento;
- Não há uma explicação plausível da eletrosfera de átomos com muitos átomos.
Estrutura do átomo: como é?
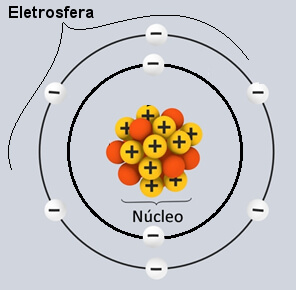 Os átomos são constituídos de, no mínimo, um próton e um elétron, além de que podem apresentar alguns nêutrons. Leia mais sobre cada um, abaixo:
Os átomos são constituídos de, no mínimo, um próton e um elétron, além de que podem apresentar alguns nêutrons. Leia mais sobre cada um, abaixo:
- Elétrons: partículas de massa pequena, movem-se muito rápido em torno do núcleo atômico, gerando alguns campos magnéticos;
- Prótons: partículas que, em conjunto com os nêutrons, formam o núcleo atômico. Elas têm carga positiva, com o mesmo valor que os elétrons. Dessa forma, um próton e um elétron atraem-se;
- Nêutrons: assim como os prótons, formam o núcleo atômico. Como têm massa bem parecida, tomam conta de 99,9% do átomo. Eles contam com carga elétrica nula, dispostas de forma estratégica no núcleo, estabilizando-o, assim. Dessa forma, dois prótons são repelidos, isso porque a adição do nêutron gera uma instabilidade elétrica e, então, o átomo se rompe.
Camadas eletrônicas: o que são?
Os elétrons coexistem entre 8 camadas, chamadas de eletrosfera. Em cada uma dessas existe um número de subníveis. A primeira é conhecida como a camada de valência, a mais energética de todas.
O átomo conta com níveis energéticos diferentes nessa camadas, determinadas por: K, L, M, N, O, P e Q. Cada camada possui um número limite de elétrons, fixados em oito elétrons cada uma. É importante saber que o átomo de hidrogênio não tem nenhum nêutron, constituído apenas por um elétron ao redor do próton.
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
👉 Continue Lendo.. Clique aqui