Os gases estão presentes no nosso cotidiano tão frequentemente que os respiramos todos os dias. O oxigênio é o gás fundamental para a manutenção da vida. Daí vemos a importância do estudo dos gases, que compreende a análise destas substâncias que estão no estado termodinâmico mais simples.
No entanto, é importante ressaltar a diferença entre gases e vapor. Substâncias que, em temperatura e pressão ambiente, se encontram no estado gasoso são gases, já outras substâncias que nestas condições são sólidas ou líquidas e mudam para o estado gasoso são chamadas de vapor.
[VEJA TAMBÉM: LEI DOS GASES – O QUE É?]

O que é o estudo dos gases?
Gases são compostos moleculares que representam um estado físico da matéria no qual o volume, a densidade e a forma não são definidos.
Características

Os gases apresentam as seguintes características:
- Alto grau de desordem: as partículas ficam distantes umas das outras;
- Altamente compressíveis;
- Expansíveis;
- Ocupam o volume total do recipiente no qual se encontram;
- Formam misturas homogêneas com outros gases.
Dessa forma, as propriedades utilizadas para estudar o comportamento dos gases são:
Pressão: é a medida da força que um gás exerce sobre um recipiente em determinada área;
Volume: medida do espaço que o gás ocupa em determinado recipiente;
Temperatura: é a medida do grau de agitação das moléculas de um gás (energia cinética).
Composição
Um gás é formado por átomos que apresentam pouca interação entre eles.
Gás ideal: um gás é chamado de ideal e é utilizado para que possamos o estudar quando está sob as determinadas condições hipotéticas:
- Ser formado por inúmeras partículas em desordem;
- O volume de cada molécula for desprezível;
- As colisões entre as moléculas são muito rápidas;
- As forças entre as moléculas são desprezíveis.
Equação geral dos gases ideais
Assim, surge a Lei dos Gases Ideais, que descreve seu comportamento:
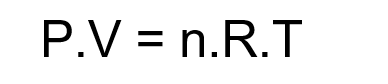 Sendo:
Sendo:
P: pressão do gás (N/m2);
V: volume (m3);
n: número de moles (mol);
R: constante universal dos gases (J/K.mol);
T: temperatura (K).
Constante universal dos gases (R): esta constante foi determinada pela Lei de Avogrado, que determina que, sob as condições ideias (temperatura 273,15 K e pressão 1 atm), 1 mol de determinado gás preenche um volume de 22,415 L.
Assim, temos que R = 8,314 J/K.mol ou 1,986 cal/k.mol. Este valor é utilizado em todas as equações gerais dos gases ideais.
Para as propriedades pressão (P), volume (V) e temperatura (T), os gases ideias comportam-se de acordo com as fórmulas:
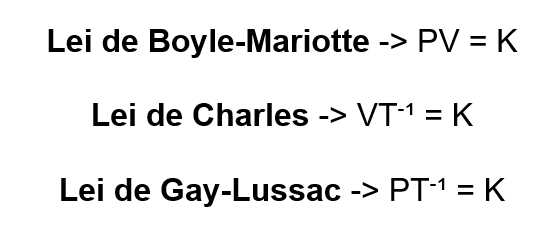
Sendo K uma constante.
Exemplos
A seguir, estão alguns dos gases que podem ser encontrados à temperatura ambiente:
- H2S: Sulfeto de hidrogênio;
- CH4: Metano;
- SO2: Dióxido de enxofre.
Agora que você já sabe um pouco mais a respeito do estudo dos gases, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
👉 Continue Lendo.. Clique aqui